Penentuan Kalium
Ditulis oleh Adam Wiryawan pada 29-01-2011
Prinsip :
Kalium (K) dapat ditentukan secara gravimetri dengan cara mengendapkannya menggunakan natrium tetra fenil boron, (NaB(C6H5)4) sebagai pereaksi pengendap.
Kalium (K) dapat ditentukan secara gravimetri dengan cara mengendapkannya menggunakan natrium tetra fenil boron, (NaB(C6H5)4) sebagai pereaksi pengendap.
Endapan yang terbentuk berupa kalium tetra fenil boron, KB(C6H5)4, tidak larut dalam air tetapi larut dalam pelarut organik seperti aseton.
K+ + NaB(C6H5)4 ? KB(C6H5)4 + Na+
Endapan dapat terbentuk dalam suasana yang sangat dingin dan sangat asam.
Tujuan :
Penentuan kadar K dalam air laut secara gravimetri dengan pereaksi pengendap natrium tetra fenil boron NaB(C6H5)4.
Penentuan kadar K dalam air laut secara gravimetri dengan pereaksi pengendap natrium tetra fenil boron NaB(C6H5)4.
Cara Kerja :
- Pipet 25,00 mL sampel air laut kedalam labu erlenmeyer 100 mL.
- Tambahkan 3,0 mL HCl pekat
- Ditaruh didalam ice-water bath selama 10 menit.
- Sekitar 10 mL larutan NaB(C6H5)4 1% dingin ditambahkan kedalam larutan diatas.
- Kocok sehingga merata sambil menutup erlenmeyer.
- Taruh kembali dalam ice-water bath beberapa menit.
- Endapan yang terbentuk disaring dengan sintered-glass crucible porosity no.4 (yang telah ditimbang). Sisa endapan dan larutan yang ada pada erlenmeyer dicuci beberapa kali dengan air dingin dan dituangkan melalui crucible.
- Crucible yang berisi endapan dikeringkan dalam oven dengan suhu 1200C sampai mencapai berat konstan.
- Endapan yang terbentuk dapat dihitung
- Percobaan ini dilakukan 3 kali
- Hitung kadar kalium (K) dalam sampel tersebut.
Faktor konversi : 1 gram endapan = 0,1091 gram K.
Penentuan Sulfat
Ditulis oleh Adam Wiryawan pada 28-01-2011
Prinsip :
Sulfat dapat ditentukan dengan cara mengendapkannya dengan barium khlorida (BaCl2) untuk membentuk endapan barium sulfat (BaSO4).
Sulfat dapat ditentukan dengan cara mengendapkannya dengan barium khlorida (BaCl2) untuk membentuk endapan barium sulfat (BaSO4).
Partikel endapan BaSO4 terlalu kecil untuk disaring sehingga perlu didigest untuk membentuk kristal yang lebih besar. Proses ini menghasilkan kristal yang sukar larut.
Salah satu alternatif untuk mengatasi masalah tersebut dapat diatasi dengan cara menambahkan larutan sampel yang panas kedalam larutan BaCl2 panas. Hal ini akan mengurangi adanya coprecipitation.
Tujuan :
Menentukan kadar sulfat dalam suatu sampel dengan cara mengendapkan sulfat tersebut dengan pereaksi pengendap BaCl2
Menentukan kadar sulfat dalam suatu sampel dengan cara mengendapkan sulfat tersebut dengan pereaksi pengendap BaCl2
Cara kerja :
- Keringkan sampel yang mengandung sulfat didalam oven selama 1 jam dengan suhu 110oC.
- Keringkan juga porselin crucible didalam oven sampai mencapai berat konstan.
- Timbang sekitar 0,3 – 0,5 gram sampel yang telah dingin didalam beaker glass 600 mL.
- Larutkan sampel dengan 150 mL aquades dan tambah 2 mL HCl pekat.
- Panaskan mendekati titik didih.
- Anggap bahwasampel adalah Na2SO4 murni dan hitung milimol BaCl2 yang diperlukan untuk mengendapkan semua sulfat tersebut.
Contoh :
426 gram sampel = 426/142 = 3 mmol Na2SO4
3 mmol Na2SO4 = 3 mmol BaCl2
Jika tersedia larutan BaCl2 0,2M, maka BaCl2 0,2M
yang diperlukan = 3/0,2 = 15 mL.
426 gram sampel = 426/142 = 3 mmol Na2SO4
3 mmol Na2SO4 = 3 mmol BaCl2
Jika tersedia larutan BaCl2 0,2M, maka BaCl2 0,2M
yang diperlukan = 3/0,2 = 15 mL.
- Tambahkan 50 ml kedalam volume tertentu dari larutan BaCl2 dan panaskan hampir mendidih.
- Sambil diaduk terus, tambahkan larutan sampel panas terlahan-lahan. Biarkan endapan terbentuk sempurna.
- Tambahkan beberapa tetes BaCl2 untuk melengkapi endapan yang terbentuk
- Setelah pengendapan lengkap, tutup beaker dengan gelas/kaca arloji. Diges endapan yang terbentuk dengan suhu dibawah titik didih.
- Setelah dingin, endapan disaring dengan kertas bebas abu (Whatmann 40).
- Cuci beberapa kali dengan aquades hangat.
- Lipat kertas saring dan taruh didalam crucible yang telah ditimbang
- Panaskan dengan burner tetapi harus cukup udara selama pemanasan sampai kertas saring telah hangat.
- Keringkan dalam tanur sekitar 1 jam atau sampai mencapai berat konstan
- Percobaan dilakukan 3 kali.
- Hitung kadar sulfat (SO4) yang ada dalam sampel
Penentuan Alumunium
Ditulis oleh Adam Wiryawan pada 27-01-2011
Prinsip :
Alumunium bereaksi dengan pereaksi pengendap organik, yaitu 5-hydroxy-quinoline untuk membentuk kelat tak larut,
Alumunium bereaksi dengan pereaksi pengendap organik, yaitu 5-hydroxy-quinoline untuk membentuk kelat tak larut,
Al3+ + 3C9H6(OH)N → Al[C9H6(O-)N:] + 3 H+alumunium oxinat pada pH sekitar 4,5 – 9,5.
Pengendapan dapat terbentuk secara sempurna jika pH larutan tidak dibawah 4,5.
Satu keuntungan dari penggunaan pengendap organik adalah pada pengeringan dapat digunakan suhu rendah.
Aseton perlu ditambahkan untuk menghindari adanya coprecipitation.
Tujuan :
Untuk menentukan kadar alumunium dalam suatu sampel dengan cara mengendapkan alumunium dalam sampel dengan pereaksi
Untuk menentukan kadar alumunium dalam suatu sampel dengan cara mengendapkan alumunium dalam sampel dengan pereaksi
Cara Kerja :
- Dapatkan sampel alum, AlK(SO4)2.12H2O, tetapi jangan dikeringkan. Timbang sekitar 0,3 – 0,4 gram sampel alum dalam beaker glass 250 mL.
- Tambahkan 50 mL aquades, 60 mL aseton, 4 mL 8-hydroxyquinoline 5% dan 40 mL amonium asetat 2M
kedalam sampel. Panaskan/uapkan aseton yang ada dalam sampel diatas hotplate atau water bath pada suhu sekitar 700C selama 2-3jam. Endapan akan tampak setelah 15 menit (suhu harus dijaga tetap sekitar 700C selama pemanasan). Setelah2-3 jam larutan didinginkan (tahap ini harus dilakukan pada waktu yang sama).
Penyaringan dan Penimbangan
- Tempat crucible (yang telah ditimbang dan dibersihkan) pada perlengkapan penghisap.
- Tuangkan larutan dan endapan yang berbentuk kedalam crucible dan cuci beberapa kali beaker glass dengan aquades.
- Keringkan endapan bersama crucible didalam oven selama 2,5 jam dengan suhu 1350C.
- Dinginkan 0,5 jam dan keringkan lagi 0,5 jam sampai tercapai berat konstan.
- Hitung kadar Al dalam sampel sebagai Al atau Al2O3.
Penentuan Klorida
Ditulis oleh Adam Wiryawan pada 26-01-2011
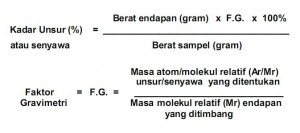
Gravimetri adalah metode analisis kuntitatif unsur atau senyawa berdasarkan bobotnya yang diawali dengan pengendapan dan diikuti dengan pemisahan dan pemanasan endapan dan diakhiri dengan penimbangan.
Untuk memperoleh keberhasilanpada analisis secara gravimetri, maka harus memperhatikan tiga hal berikut ;
- Unsur atau senyawa yang ditentukan harus terendapkan secara sempurna.
- Bentuk endapan yang ditimbang harus diketahui dengan pasti rumus molekulnya.
- Endapan yang diperoleh harus murni dan mudah ditimbang.
Dalam analisis gravimetri meliputi beberapa tahap sebagai berikut ;
- Pelarutan sampel (untuk sampel padat).
- Pembentukan endapan dengan menambahkan pereaksi pengendap secara berlebih agar semua unsur/senyawa diendapkan oleh pereaksi. Pengendapan dilakukan pada suhu tertentu dan pH tertentu yang merupakan kondisi optimum reaksi pengendapan. Tahap ini merupakan tahap paling penting.
- Penyaringan endapan.
- Pencucian endapan, dengan cara menyiram endapan di dalam penyaring dengan larutan tertentu.
- Pengeringan endapan sampai mencapai berat konstan.
- Penimbangan endapan.
- Perhitungan.
Tabel 10.1. Beberap contoh faktor gravimetri.
PENENTUAN KLORIDA
Prinsip :
Ion klorida dalam larutan diendapkan dari larutan asam sebagai perak klorida (AgCl).
Ion klorida dalam larutan diendapkan dari larutan asam sebagai perak klorida (AgCl).
Cl + Ag+ ?AgCl (endapan)
Endapan yang terbentuk mula – mula berbentuk koloid tetapi kemudian akan menggumpal membentuk agregat. Endapan yang terbentuk mudah tersebut dicuci dan disaring. Sebagai pencuci digunakan larutan asam nitrat (HNO3) encer. Air tidak dapat digunakan sebagai pencuci.
Perak klorida yang terbentuk disaring melalui sintered-glass crucible, bukan dengan kertas saring karena AgCl mudah direduksi menjadi Ag bebas oleh karbon dalam kertas saring selama pembakaran kertas saring.
Tujuan :
Menetapkan kadar klorida dalam suatu sampel dengan cara mengendapkan ion khlorida yang ada dalam sampel menggunakan perak nitrat (AgNO3).
Menetapkan kadar klorida dalam suatu sampel dengan cara mengendapkan ion khlorida yang ada dalam sampel menggunakan perak nitrat (AgNO3).
Cara kerja :
- Dapatkan sampel yang mengandung ion klorida yang larut dan keringkan dalam oven sekitar 1 jam dengan suhu 1100C.
- Dinginkan dalam desikator
- Timbang sekitar 0,4 – 0,7 gram sampel tersebut di dalam gelas kimia 400 mL.
- Tambahkan 150 mL aquades bebas khlorida dan 0,5 mL (10 tetes) asam nitrat (HNO3) pekat.
- Aduk sampai merata dengan batang pengaduk dan tinggalkan batang pengaduk pada beaker glass.
- Anggap sampel tersebut adalah NaCl murni dan hitung milimol AgNO3 yang dibutuhkan untuk mengendapkan.
Contoh :
410 mg sampel = 410/58,5 = 7 mmol NaCl
7 mmol NaCl = 7 mmol AgNO3
Jika tersedia larutan AgNO3 0,5 M, maka larutan AgNO3 0,5 M
yang diperlukan 7/0,5 = 14 ml
7 mmol NaCl = 7 mmol AgNO3
Jika tersedia larutan AgNO3 0,5 M, maka larutan AgNO3 0,5 M
yang diperlukan 7/0,5 = 14 ml
- Tambahkan larutan AgNO3 tersebut secara perlahan- lahan sambil diaduk dan lebihkan 10% penambahan larutan AgNO3.
- Panaskan gelas kimia yang berisi larutan, sampai hampir mendidih sambil diaduk terus menerus. Hindarkan beaker dari sinar matahari langsung.
- Tambahkan satu dua tetes larutan AgNO3 untuk mengetahui apakah semua khlorida dalam sampel telah diendapkan atau belum. Bila dengan penambahan larutan menjadi keruh, tambahkan lagi AgNO3 dan panaskan kembali. Dan perlu diperiksa kembali dengan penambahan satu-dua tetes larutan AgNO3. Dinginkan larutan dan tutup dengan kaca arloji sekitar satu jam.
Penyaringan dan Penimbangan
- Tempatkan sintered – glass crucible (yang telah ditimbang) pada perlengkapan penghisap.
- Tuangkan larutan sampel yang telah diendapkan ion kloridanya ke crucible.
- Cuci endapan dengan larutan HNO3 encer (0,6 mL HNO3 pekat dalam 200 mL), juga sisa yang ada dalam beaker glass beberapa kali.
- Keringkan endapan didalam oven selama 2 jam dengan suhu 1100C.
- Dinginkan dalam desikator
- Timbang endapan yang telah dingin
- Hitung kadar khlorida dalam sampel menggunakan BA Cl = 35,45 dan Mr AgCl = 143,32.
Sumber : http://www.chem-is-try.org/kategori/materi_kimia/instrumen_analisis/gravimetri/






0 komentar:
Posting Komentar